Le sperimentazioni cliniche (“clinical trials” in inglese) sono l’ultimo stadio della ricerca biomedica, quello in cui si determina se i risultati scientifici ottenuti ne consentano l’introduzione o meno nella pratica medica. In altre parole, se il lungo e costoso processo di ricerca finanziato dai promotori (spesso l’industria farmaceutica) abbia avuto successo (o meno) e possa quindi ripagare delle tante fatiche e soldi spesi. È quindi un passaggio critico, forse il più critico, e come tale necessiterebbe dei massimi rigore e trasparenza.
Le sperimentazioni cliniche si dividono in quattro fasi: nella fase I si studia la tossicità del nuovo farmaco/(procedura proposto, nella II l’efficacia (in via preliminare), nella III sempre l’efficacia (ma in modo accurato e definitivo), nella IV si sorvegliano eventuali problemi che dovessero sorgere dopo l’immissione in commercio e/o l’applicazione nella pratica medica.
Data l’importanza dell’argomento (sottoporre o meno i pazienti ad una innovativa pratica clinica) i risultati delle sperimentazioni dovrebbero essere garantite dalla massima accessibilità e trasparenza, soprattutto per chi è esperto nel campo.
Ma non è così: una recente indagine condotta da diversi scienziati indipendenti [John Carlisle (anestesista presso l’England National Health Service); Ian Roberts (epidemiologo alla London School of Hygiene & Tropical Medicine; ed altri), ha mostrato che in una alta percentuale di studi, i dati grezzi relativi alla risposta individuale dei pazienti (“raw data” in inglese) che sarebbero necessari per verificare la validità delle conclusioni tratte, non vengono forniti dagli autori della sperimentazione.
Ciò che più spesso è accaduto è che chi li ha richiesti, anche essendo un esperto nella disciplina, non ha ottenuto alcuna risposta. Altre volte gli/le è stato risposto che i dati erano andati persi perché il computer era stato rubato o addirittura durante il trasloco di casa……
L’Associazione Luca Coscioni ben conosce questo tipo di opacità: durante la pandemia da Covid, fu impossibile ottenere i dati individuali dei pazienti sulla base dei quali venivano prese le decisioni a livello politico, ma furono resi pubblici solo i dati complessivi relative alle popolazioni esaminate (cosiddetti dati in “forma aggregata”).
Anche per ottenere in forma grezza/aperta (una parte) dei dati sulla presenza di medici obiettori/non obiettori alla Interruzione Volontaria di Gravidanza nelle diverse strutture mediche italiane, i nostri Consiglieri Chiara Lalli e Sonia Montegiove hanno sudato più di sette camicie (pur essendo inverno) .
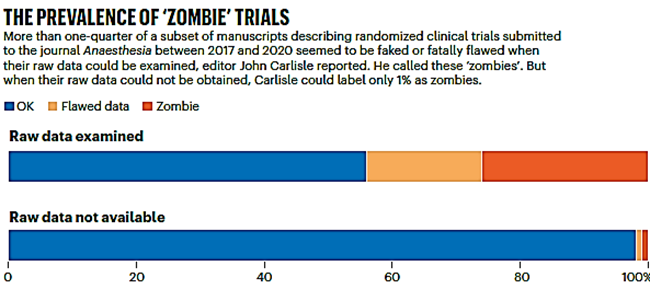
Sudando probabilmente anch’essi un certo numero di camicie, John Carlisle, Ian Roberts e gli altri hanno potuto ottenere dati grezzi in numero sufficiente per poter calcolare che le risultanze di più del 25% delle sperimentazioni cliniche sottoposte per la pubblicazione alla prestigiosa rivista scientifica Anaesthesia tra il 2017 e il 2020 contenevano dati fraudolenti o gravemente sbagliati, tali da mettere a repentaglio la validità delle conclusioni dello studio [un po’ cinematograficamente le hanno chiamate “zombie trials” ossia “sperimentazioni cliniche morte che camminano” (v. figura)]. Se invece gli analisti indipendenti non riuscivano ad ottenere e poter quindi analizzare i dati grezzi, quella percentuale di sperimentazioni “zombie” scendeva al 1%, con la conseguente validazione di risultati che validi non erano.
Forse il Ministero della Salute e quello della Ricerca dovrebbero occuparsi di questo problema, a tutela della salute dei pazienti potenzialmente trattati con terapie “innovative”.

Guido Frosina si è laureato in Scienze Biologiche presso l’Università e la Scuola Normale Superiore di Pisa nel 1981. Ha conseguito il Dottorato di Ricerca in Genetica presso l’Università di Ferrara nel 1987. Ha svolto ricerche in campo oncologico presso l’Institut Gustave Roussy – France, l’Imperial Cancer Research Fund – UK e dal 1987 è Dirigente Sanitario presso l’IRCCS Ospedale Policlinico San Martino di Genova. Si occupa attualmente di radioterapia dei tumori cerebrali e di qualità ed integrità della Ricerca.